
DOI:10.1016/j.biomaterials.2020.120034
适当的巨噬细胞对植入生物材料的响应对于组织愈合的成功至关重要。在这项工作中,研究了电纺生物材料和外部机械载荷的内在拓扑线索如何协同引导巨噬细胞活化以及巨噬细胞-肌腱成纤维细胞的串扰效应。在机械加载和未加载的条件下,使用定向或随机取向的聚己内酯纳米纤维基质进行了一系列的体外和体内实验。在所有实验中,无序的生物材料纤维形态足以促进巨噬细胞、肌腱成纤维细胞和肌腱组织中的促炎信号。研究发现外部机械负荷通过在体内和体外减少促炎性标志物来强烈调节该标志的特征。研究者观察到,与肌腱成纤维细胞相比,巨噬细胞通常显示出对生物物理线索的更强响应,在机械共培养模型中观察到这些细胞类型之间的串扰效应尤为显著。总的来说,这些研究数据表明巨噬细胞在肌腱修复中作为机械感觉细胞发挥着潜在的重要作用,并提供了对合理的生物材料设计如何治疗性调节生物学反应的见解,这些设计可以解决募集细胞的生物力学生态位。
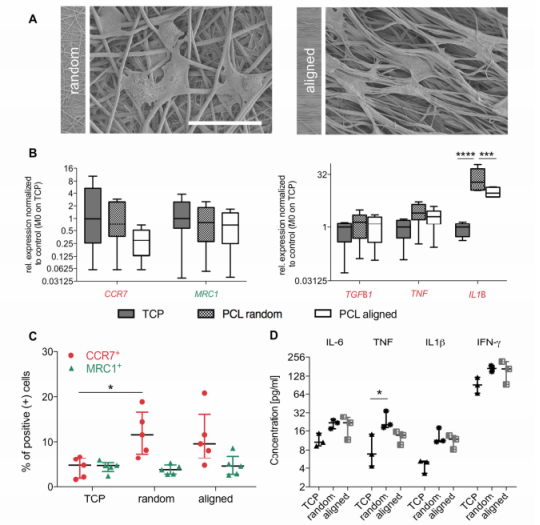
图1:在体外,随机取向的基底促使巨噬细胞向增强的促炎表型极化。(A)SEM图像显示附着在随机(左图)和定向(右图)PCL基质上的巨噬细胞之间的形态学差异,平均纤维直径为700 nm,在定向基底上有细长的细胞。(B)在随机(棋盘格)和定向(白盒)基底上培养的M0巨噬细胞中,CCR7(M1样)和MRC1(M2样)的基因表达水平相似。在随机取向的纤维上培养的细胞中,检测到IL1B的表达明显增加,而TNF和TGFB1的表达水平保持不变。(C)流式细胞仪分析显示,如果在随机基底上培养,则M0巨噬细胞向促炎(CCR7+)表型极化。通过测量在随机排列的PCL纳米纤维基底上培养的M0巨噬细胞中CCR7(红色点)和MRC1(绿色三角形)阳性细胞的百分比来进行评估。(D)暴露于不同地形线索的巨噬细胞中的细胞因子分泌显示出在随机基底上培养的细胞中促炎性细胞因子TNF的蛋白质释放显著增加。数据表示为n=6(B)、5(C)、3(D)的中位数,且具有四分位数范围,并且当*P≤0.05时,表明数据具有显著性差异。通过双向方差分析与Tukey的多重比较测试进行统计学分析,以评估两组之间基因表达水平的统计学差异。此外,进行了带有Dunn事后检验的KruskalWallis非参数方差分析,将每种治疗方法与其对应的对照组(TCP上的M0)进行比较(C,D)(*P≤0.05,***P≤0.001,****)P≤0.0001)。比例尺代表50µm(放大倍数)。
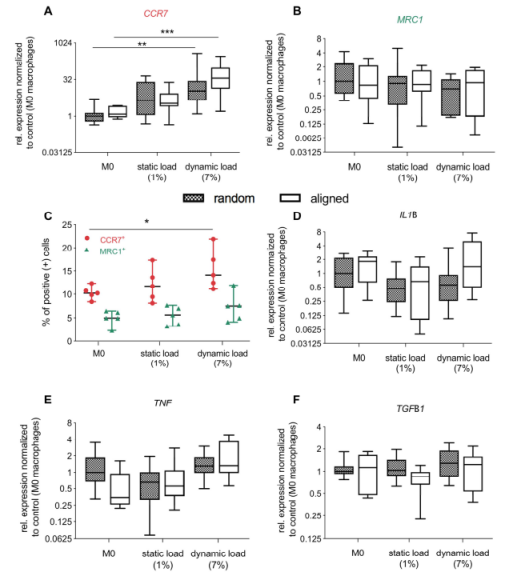
图2:动态加载M0巨噬细胞在体外诱导向促炎性M1样表型的极化转变。(A,B)机械负荷会上调M0巨噬细胞中CCR7(M1标记)的表达。由于动态负载,CCR7显著增加,而MRC1基因表达保持不变(n=9)。(C)与未负载的对照组(随机基底上的M0)相比,CCR7阳性细胞的百分比表明动态负载细胞群中的极化移位(n=6)。(D-F)另外,与静态负载条件相比,动态负载下测定炎性细胞因子IL1B、TNF和TGFB1的基因表达水平。结果通过其中位数归一化为随机无负载基质上的M0巨噬细胞(n=9)。使用Kruskal Wallis非参数ANOVA与Dunn事后检验进行统计学分析,比较每种治疗方法及其相应的对照组(随机或对齐的PCL上的M0)进行比较(*P≤0.05,**P≤0.01,***P≤0.001)。
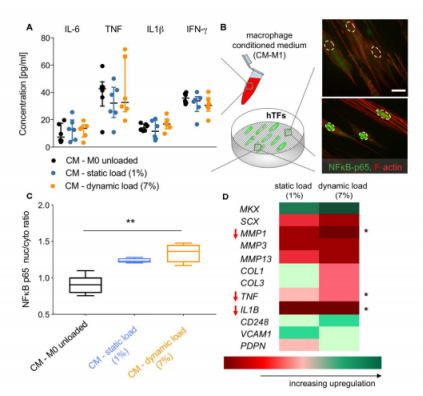
图3:体外巨噬细胞条件培养基(CM)刺激的hTFs的免疫反应。(A)使用多重ELISA在上清液中测量机械调节的巨噬细胞中的细胞因子分泌。在机械负载(1%和7%菌株)和未负载巨噬细胞(n=6)的上清液中测量IL-6、TNF、IL1β和IFN-γ的水平。(B) 将hTFs接种于经促炎性巨噬细胞条件培养基(CM-M1)刺激的F-actin(红色)和NF-κB-p65(绿色)染色的定向基质上(虚线表示细胞核的位置)。(C) 对p65的免疫染色显示,动态负载巨噬细胞受CM刺激的hTFs中核p65显著增加。在随机基底上培养的未负载M0巨噬细胞条件的培养基作为对照组(n=4)。(D)基因表达分析揭示了机械负载巨噬细胞受CM刺激的hTFs中MMP1的较低表达。在受CM刺激的hTF中,肌腱基因表达和成纤维细胞活化的标记无显著变化。此外,在暴露于机械负载巨噬细胞培养基的hTFs中,发现炎性细胞因子TNF和IL1B的表达水平显著降低(n=6)。使用Kruskal Wallis非参数ANOVA和Dunn事后测试进行分析,比较每种治疗方法及其相应的对照组(未负载M0的CM)(*P≤0.05,**P≤0.001)。比例尺代表20µm。
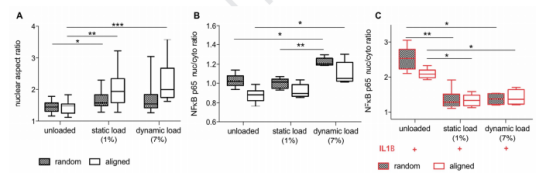
图4:机械负荷可防止IL1B在体外激活NFκB。(A) 核长宽比的量化表明,随着负荷的增加,核形状的延伸率显著增加,在定向基底(白盒)上培养的细胞中标记更明显(n=3)。(B)hTFs的动态负载导致核p65的存在增加。这种效应在随机接种的细胞(棋盘格)上比在定向(白盒)基质(n=6)上更明显。(C) 机械刺激后用IL1B进行促炎性刺激可显著减少p65亚单位易位(n=6)。采用Kruskal-Wallis非参数ANOVA和Dunn事后测试进行统计学分析,比较每种治疗方法及其相应的对照组(PCL上的M0随机或对齐,无负荷)(P≤0.05,**P≤0.01,**P≤0.001)。
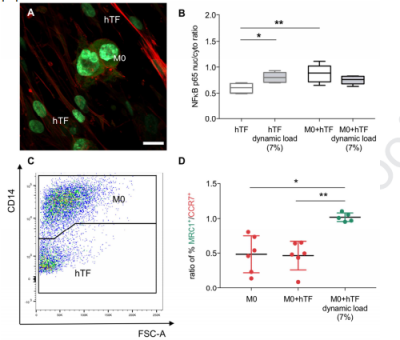
图5:M0和hTF的直接共培养可增加hTF中核NFκB-p65的易位。(A)在定向PCL基底上培养的M0巨噬细胞和hTF的免疫荧光染色,对F-肌动蛋白(红色)、DNA(蓝色)和NFκB-p65(绿色)进行染色。(B)对hTF中NFκB-p65的核转运进行定量分析显示,与M0巨噬细胞共培养时,其水平显著增加。然而,在机械刺激条件下,核p65含量较低(n=5)。(C)使用CD14和CD90染色,通过流式细胞术检测细胞群。CD14阳性和CD90阴性细胞表示巨噬细胞,而CD90阳性和CD14阴性细胞表示肌腱成纤维细胞。(D)CD14+/CD90-细胞极化标记物CCR7+(M1型标记)和MRC1+(M2型标记)的进一步门控表明,如果在直接共培养中暴露于7%动态负荷下,则有向抗炎巨噬细胞极化的趋势。MRC1+/CCR7+细胞之间的比例显示,在动态负载的共培养条件下(n=6),MRC1+阳性细胞的比例显著增加。具体而言,对于M0单培养,CCR7+细胞的百分比为4.5%,对于M0+hTF共培养,为4.32%,对于动态负载共培养,为4.745%。对于MRC1+细胞,测定了2.45%为单培养,2.14%为共培养以及4.7%为动态负载共培养。使用KruskalWallis非参数ANOVA与Dunn事后检验进行统计分析,比较每种治疗方法及其相应的对照组(分别为hTF,未负载或M0在PCL上对齐,未负载)(*P≤0.05,**P≤0.01)。比例尺代表20µm。
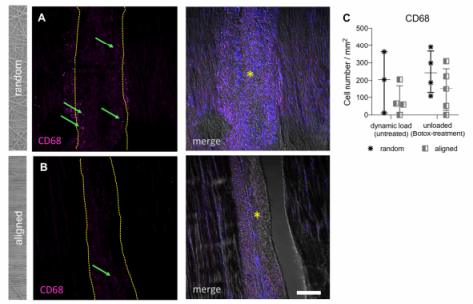
图6:PCL支架与体内不同纤维组织的组织整合。(A,B)植入大鼠跟腱后7天,随机取向(上图)和定向(下图)支架的抗CD68染色。核染色(DAPI,合并,右图)显示了两种构建体中都有大量宿主细胞,而抗CD68染色(粉红色,左图)定性表明在随机取向的样品中免疫细胞覆盖了更多/更大的区域。A和B中的黄色虚线(星号)表示支架在组织中的位置。比例尺代表100 µm。(C)每单位面积细胞数量的半定量分析表明,随机取向的纤维支架周围和随机染色的免疫细胞数量变化很大,与体外观察结果一致,机械卸载和纤维解离促进了促炎信号。使用Kruskal Wallis非参数ANOVA和Dunn的多重比较检验进行统计分析,以评估两组之间的统计差异(p=0.333)。
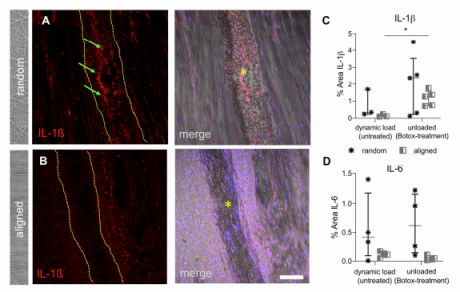
图7:促炎细胞因子分泌对体内电纺纤维排列和肌肉力量敏感。放置在未治疗动物的肌腱中的随机取向(A)和定向(B)支架(虚线之间,星号)的代表性图像,并用IL-1ß抗体染色(IL-1ß-左图中的红色信号,右图为IL-1ß信号、DIC和核染色的合并)。(C)组织切片上IL-1ß表达的半定量分析。宿主细胞植入定向支架后,IL-1的分泌明显增加。采用Mann-Whitney试验进行统计分析,分别比较动态负载(未处理)和未负载(肉毒杆菌处理组)组的定向支架和随机支架(*P≤0.05)。比例尺代表100μm。
